El comité HMPC (Committee on Herbal Medicinal Products) de la EMA ha publicado un concept paper sobre la revisión de la guía sobre buenas prácticas agrícolas y de recolección (BPAR, y en sus sigas en inglés GACP) para los materiales de partida a base de plantas. La EMA está aceptando comentarios hasta el 1 de junio de 2022.
Marco Previo
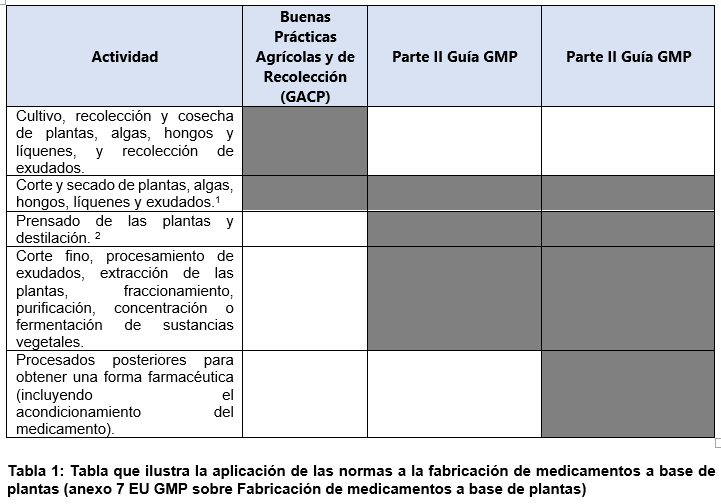
Para garantizar los “materiales de partida” a base de plantas de forma reproducible y consistente, se requiere un sistema apropiado de garantía de calidad para su producción agrícola adecuada. Por ello, las actividades de cultivo, recolección y cosecha, así como el procesamiento primario, han de cumplir con las exigencias sobre buenas prácticas agrícolas y de recolección GACP. Tras el creciente número de empresas que se están autorizando para el cultivo y producción de Cannabis medicinal, el marco GACP requiere ser revisado para la incorporación de nuevas mejoras. Desde la publicación del Anexo 7 revisado de la EU GMP (Fabricación de medicamentos a base de plantas) en septiembre de 2009, han surgido algunas cuestiones sobre la aplicación del marco GACP y/o GMP que han conllevado a la actualización de la guía GACP actual. Recordar, que la clasificación conforme a las GMP de un material vegetal depende del uso que dé el titular de la autorización de fabricación a dicho material (sustancia activa, producto intermedio o producto terminado) y que es responsabilidad del fabricante del medicamento garantizar que se aplica la clasificación adecuada de las GMP. Ver Tabla 1.
Aclaración marco GMP vs GACP
La revisión de la guía aborda la necesidad de aclarar el alcance y/o posibles superposiciones entre las GMP y GACP, diversas prácticas en los Estados miembros, la incertidumbre sobre los requisitos, la certificación y la presentación de expedientes, así como la comparación con otros estándares de buenas prácticas (por ejemplo, el establecido por la Organización Mundial de la Salud, OMS). Además, se pretende mejorar la coherencia con otras directivas y regulaciones de la UE (por ejemplo, las relacionadas con el agua, suelo, pesticidas). Además, se espera una contribución positiva para la gestión sostenible de los recursos y el control de calidad de las plantas medicinales salvajes cosechadas.
Finalmente, se espera que la guía revisada facilite la comprensión de los requisitos aplicables para garantizar y demostrar que los materiales de partida a base de plantas se cultivan, recolectan y / o cosechan conforme a GACP, ayudando a los solicitantes en la preparación de sus expedientes de autorización, así como a las autoridades competentes en su posterior evaluación.
Calendario propuesto
Se prevé que el borrador de la guía revisada esté disponible seis meses después de la adopción del Concept Paper. El borrador será presentado para consulta pública durante un periodo de tres meses. La guía revisada podría estar finalizada dentro de los seis meses posteriores al periodo de consulta.
Si está evaluando la necesidad de contar con un proveedor experto para asegurar y agilizar la correcta consecución de un proyecto relativo a Medicamentos a base de plantas, ahorrando imprevistos y recursos, no pierda más tiempo y contacte con nosotros, nos encantará tener noticias suyas y sumarnos a su proyecto.
[1] Los fabricantes deberán garantizar que estos pasos se lleven a cabo de acuerdo con lo establecido en la autorización de comercialización/registro. Para aquellos pasos iniciales que tengan lugar sobre el terreno, serán de aplicación las Buenas Prácticas Agrícolas y de Recolección para materiales de partida de origen vegetal (GACP), tal y como se justifique en la autorización de comercialización/registro. Las GMP son de aplicación para los sucesivos pasos de corte y secado.
[2] Si fuera necesario, las actividades de prensado de plantas y la destilación podrán formar parte integral de la cosecha para mantener la calidad del producto dentro de las especificaciones aprobadas. Dichas actividades se podrán llevar a cabo sobre el terreno, siempre y cuando los cultivos cumplan las GACP. Estas circunstancias serán en todo caso excepcionales y deberán justificarse en la documentación de la autorización de comercialización/registro pertinente. En cuanto a las actividades llevadas a cabo sobre el terreno deberá garantizarse la existencia de una documentación, control y validación apropiados conforme con los principios de las GMP. Las autoridades reguladoras podrán llevar a cabo inspecciones de GMP de estas actividades con el fin de evaluar su cumplimiento.
