En diciembre de 2023, la EMA y la HMA publicaron conjuntamente la primera versión completa del documento sobre Marco de Calidad de Datos para la regulación de medicamentos en la EU. Este documento tiene como objetivo caracterizar, evaluar y garantizar la calidad de datos para el respaldo de la toma de decisiones regulatorias.
Introducción y foco
El progreso en la digitalización y la tecnología de la información ha creado nuevas oportunidades que han contribuido a un panorama cada vez más complejo para la toma de decisiones regulatorias. Por ello, se está reconociendo una creciente necesidad de estandarización y la implementación de un marco que describa la calidad de datos. Este marco permitiría al regulador realizar evaluaciones regulatorias confiables sobre si los datos son apropiados para respaldar la toma de decisiones. Pero, aunque se dispone de nuevos tipos o estándares de datos, todavía son escasas las directrices o métodos para demostrar si dichos datos son adecuados para la toma de decisiones.
Por todo ello, se ha visto necesario por parte de la European Medicines Agency (EMA) y la Heads of Medicines Agencies (HMA) la elaboración de un documento Marco de Calidad de Datos (DQF, por sus siglas en inglés) que brinde orientación y guía para el logro de procedimientos de evaluación de calidad coherentes y consistentes. Este documento de 42 páginas, ha sido publicado en el mes de diciembre de 2023, tras ser actualizado tras los comentarios recibidos durante su versión preliminar de octubre de 2022.
Tal y como se reconoce en las recomendaciones del Grupo de Trabajo Conjunto de la HMA-EMA y el plan de trabajo del Grupo Directivo Conjunto de la HMA-EMA sobre Big Data, el establecimiento de un marco de la EU para la calidad y representatividad de los datos es un elemento crítico para aprovechar todo el potencial de los datos (big data) e impulsar las decisiones regulatorias.
Con el establecimiento de un marco de calidad de datos la EMA y la HMA pretenden:
- Mejorar la coherencia en la evaluación de la calidad de datos utilizados por los reguladores.
- Facilitar el desarrollo de un enfoque estandarizado para la calidad de datos en todas las fuentes de datos.
- Favorecer un uso más sistemático de los datos en la toma de decisiones regulatorias.
- Apoyar la confianza de los interesados en los datos que respaldan las decisiones regulatorias.
Este marco va alineado además con el objetivo principal del plan de trabajo del Grupo Directivo Conjunto de la HMA-EMA sobre Big Data que es el de desarrollar pautas para el logro de un proceso fortalecido para la cualificación de datos a través de asesoramiento científico, y promover en los Estados miembros la adopción de registros electrónicos de salud, registros, datos genómicos y la disponibilidad segura de los datos.
Alcance y contenido
El documento es la primera publicación del Marco de Calidad de Datos de la EU (DQF) para la regulación de medicamentos y define principios y procedimientos de alto nivel que se aplican en todo el mandato regulatorio de la EMA. Por ello, brinda un análisis sobre las acciones y métricas de calidad de datos que deben considerarse en diferentes casos de uso e introduce un modelo de madurez para guiar la evolución de la automatización para respaldar la toma de decisiones regulatorias basada en datos.
El objetivo es proporcionar un conjunto de definiciones, principios y directrices para su aplicación de forma coherente en cualquier fuente de datos con el fin de caracterizar, evaluar y asegurar la calidad del conocimiento para la toma de decisiones regulatorias. Este marco está destinado además a abarcar el uso primario y secundario de los datos, así como metadatos e información de respaldo.
Sobre las verificaciones de calidad de datos, estas ocurren en varios pasos a lo largo del proceso de generación de evidencia y pueden incluir ciclos de retroalimentación iterativos tal y como se indica la línea discontinua de la figura 1.
Figura 1: Flujo de trabajo típico de procesamiento de datos en el proceso de generación de evidencia.
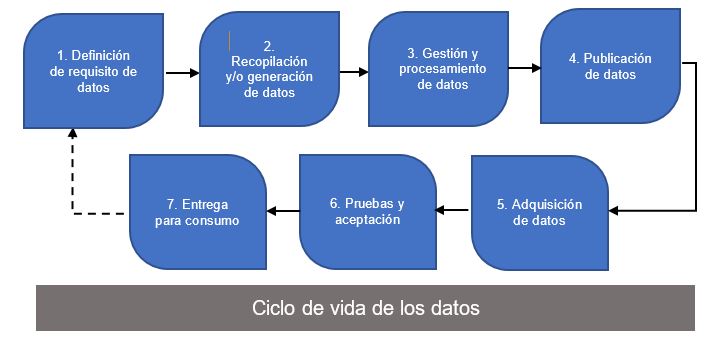
Por otra parte, dentro del alcance, el documento quiere hacer reseña del concepto de dato, que define como “cualquier activo de información que representa mediciones u observaciones y que pueden usarse para apoyar la toma de decisiones, directa o indirectamente a través del análisis”, así como del de Calidad de datos que define como “la idoneidad para el propósito de las necesidades de los usuarios en relación con la investigación en salud, la formulación de políticas y la regulación, y que los datos reflejan la realidad que intentan representar.”
Se remarca por lo tanto que la calidad de datos debe ser evaluada desde el punto de vista de su idoneidad para satisfacer las necesidades de los usuarios.
Por otra parte, el documento está dirigido principalmente a la red reguladora de medicamentos de la EU, pero la relevancia del contenido puede ser de interés para una gama más amplia de partes interesadas, como titulares de autorizaciones de comercialización, titulares de fuentes de datos, investigadores y asociaciones de pacientes.
Consideraciones en la implementación del DQF
Por otra parte, el nuevo documento marco proporciona un conjunto de observaciones y recomendaciones guía en la implementación del DQF para el logro de mayores niveles de madurez. El documento destaca las siguientes:
- Asegurar la calidad en origen: Al diseñar procesos de recopilación y generación de datos, los aspectos que afectan a la calidad de datos deben abordarse de forma inicial ya que cuanto más se alejan los datos del contexto original, más difícil resulta corregir los problemas. Este asunto es particularmente relevante en el caso de los metadatos, ya que el conocimiento del contexto de generación de datos está presente solo en el momento de la generación.
- Disponibilidad de datos maestros (MDM) y datos de referencia: La disponibilidad de MDM y datos de referencia tiene un impacto directo en la calidad de datos. A menudo es un requisito previo para la coherencia de los datos e incluso puede afectar la confiabilidad en algunos escenarios de producción de datos, ya que la información desconectada puede generar información errónea.
- Alineación del SGC: Un Sistema de Gestión de Calidad es un enfoque formalizado adoptado por una organización que documenta procesos, procedimientos y responsabilidades para lograr políticas y objetivos de calidad (por ejemplo, Good Clinical Practices [GCP], Good Laboratory Practices [GLP] or Good Manufacturing Practice [GMP]). A su vez, estándares como la familia ISO 9000 definen el SGC en todas las industrias, pero se han desarrollado SGC más específicos para industrias o productos específicos. Dentro del sector Life Sciences podemos resaltar los siguientes estándares:
- ISO 14155 y Directiva de la UE 2001/20/EC para GCP (datos de ensayos clínicos)
- Quality System Regulation (QSR) e ISO 13485 para dispositivos médicos.
- Directiva de la UE 2004/9/EC y 2004/10/EC para GLP (datos de investigación de laboratorio).
- ISO 15189 e ISO 17025 (datos de laboratorios clínicos).
- Controles sobre los sistemas informáticos: Ante el actual marco de digitalización, los sistemas informáticos utilizados para crear, modificar, mantener, archivar, recuperar o transmitir datos son un elemento crucial a tener en cuenta cuando hablamos de calidad de datos. Debemos por ello, asegurar que disponemos de sistemas informáticos efectivos, confiables y de alta calidad. La validación del sistema informático garantiza que el software se implementa adecuadamente y que existan los controles de proceso necesarios para usarlo de acuerdo a especificaciones, incluyendo la documentación asociada, el control de acceso, la gestión de proveedores y las auditorías. Por otro lado, debemos contar con un ciclo de vida de desarrollo de software que incluya un sistema de garantía de calidad del software para garantizar su diseño, desarrollo y verificación cuando el dato del SW es el propio producto (ej.: software de dispositivo médico).
- El papel de los estándares ISO de la industria: La Organización Internacional de Normalización (ISO) ha elaborado normas que proporcionan marcos para la implementación de diversos aspectos de la gestión de datos, que se prueban en el campo y para las cuales se establecen plataformas, servicios de apoyo y organismos de certificación. Estos estándares a menudo se desarrollan para la implementación de industrias donde no se aplica la toma de decisiones regulatorias de la EMA.
- ISO 9000: Describe los estándares para los sistemas de gestión de calidad en todos los niveles de una organización. Se podría considerar la adopción de esta norma si no se aplica ningún SGC específico de la industria.
- ISO 8000: Describe los estándares de gestión de calidad de datos de una organización sometidos a un ciclo de mejora continua. La ISO 8000-150 especifica los principios fundamentales de la gestión de la calidad de datos maestros, centrada en los procesos, y los requisitos para la implementación, el intercambio de datos y la procedencia.
- ISO 25012: Define un modelo general de calidad de datos para datos retenidos en un formato estructurado dentro de un sistema informático, típico de los datos considerados para la toma de decisiones regulatorias. Proporciona un marco para establecer requisitos de calidad de datos, medidas de calidad de datos y un plan para realizar evaluaciones de calidad de datos. En un modelo de Calidad de Datos se establecen las 15 características de Calidad de Datos que se deben tener en cuenta a la hora de evaluar las propiedades de un producto de datos determinado (exactitud, completitud, consistencia, credibilidad, actualidad, accesibilidad, conformidad, confidencialidad, eficiencia, precisión, trazabilidad, comprensibilidad, disponibilidad, portabilidad y recuperabilidad).
- ISO 13485: Es la norma que especifica los requisitos de un sistema de gestión de la calidad para que una organización diseñe, construya y obtenga autorización para dispositivos médicos que cumplan sistemáticamente con los requisitos reglamentarios y del cliente.
- Consideraciones sobre integridad de datos: ALCOA ++ es un marco para la integridad de los datos utilizado en toda la industria farmacéutica. Postula un conjunto de atributos que deben cumplir los datos y su documentación para que éstos sean Atribuibles, Legibles, Contemporáneos, Originales, y Acertados (ALCOA). El ++ se refiere a los siguientes atributos: Completo, Consistente, Duradero, Disponible, Trazable.Siguiendo esta premisa, debemos centrarnos en los determinantes fundamentales que afectan principalmente las dimensiones de Confiabilidad de los datos, pero también en las de Extensión, Coherencia y Oportunidad.
Figura 2: Atributos ALCOA ++

| ATRIBUIBLE: Atribuible a la persona o sistema que genera los datos. Vinculado a la fuente de datos LEGIBLE: Fácilmente legible por ser humano (reúne toda la información para que dato sea completo) CONTEMPORÁNEO: Registrados en el momento de su adquisición ORIGINAL: Primer registro del dato, o “True Copie” que preserve el contenido y significado ACERTADO: Verificado como correcto. Sin error. Verificación de cálculos, algoritmos++ completo, consistente, duradero, disponible, trazable. |
- Controles sobre la Calidad de datos: Existen diferentes implementaciones posibles de controles de calidad de datos dependiendo si los hechos reales que representan los datos son conocidos y accesibles o no. En caso que los hechos reales sean conocidos, los datos se pueden probar mediante validación (versus los registros fuente que contienen estos hechos), aunque la validación puede ser costosa y consumir mucho tiempo, y a menudo requiere el uso de evaluadores si los hechos no están disponibles en forma estructurada y legible. Alternativamente, los datos se pueden probar mediante métricas de plausibilidad intrínsecas, evaluando el conjunto de datos con respecto a: otros datos del mismo conjunto de datos, diferentes rangos de referencia externos o otras tendencias plausibles (ciertos datos pueden ser válidos cuando se observan individualmente, pero la tendencia colectiva de todos los datos de un tipo debe seguir las distribuciones o tendencias esperadas).
Conclusiones
La calidad de datos es un elemento crucial para realizar todo el potencial de la regulación basada en datos y respalda la confianza de los pacientes y profesionales de la salud. El proyecto de Marco de Calidad de Datos para la regulación de medicamentos en la Unión Europea establece los criterios de calidad para los datos para garantizar que éstos sean aptos para el propósito de respaldar las decisiones de beneficio-riesgo.
Normativas de referencia
- European Medicines Regulatory Network Data Standardisation Strategy. December 16th, 2021.
- Big Data Steering Group, Big Data Workplan 2022-2025.
- Good Practice Guide for the use of the Metadata Catalogue of Real-World Data Sources, EMA/787647/2022.
- Guideline on computerised systems and electronic data in clinical trials. EMA/INS/GCP/112288/2023.
- PIC/S Guidance. Good practices for data management and integrity in regulated GMP/GDP environments. PI 041-1. 1 July 2021.
- Good Practice Guide for the use of the Metadata. Catalogue of Real-World Data Sources. EMA/787647/2022. V 1.0 (draft)
Acrónimos
- DQF: Data Quality Framework
- EMA: European Medicines Agency
- HMA: Heads of Medicines Agencies
- EU: European Union
- MDM: Master Data Management
- SGC: Sistema de Gestión de Calidad
- ISO: International Organization for Standardization
- EHDS: European Health Data Space
¿Qué ofrece Trescal?
TRESCAL es un proveedor global de servicios para la industria Life Sciences que ofrece servicios de implantación/consultoría en sistemas de calidad, gestión de riesgos, Data Integrity, Data Governance, validación de sistemas informáticos, cualificación de equipos, calibraciones. Nuestro conocimiento específico y transversal nos permite ofrecer un servicio global de calidad como especialistas en la materia en los puntos que necesiten.
Si está evaluando la necesidad de contar con un proveedor experto para adecuar su sistema de gestión de calidad al nuevo marco de calidad de datos, revisando estrategias y controles, o si necesita soporte en la realización de verificaciones y validaciones no pierda más tiempo y contacte con nosotros, nos encantará tener noticias suyas y sumarnos a su proyecto.
