Introducción y marco previo regulador
En los últimos años, la tecnología ha avanzado significativamente, y la industria regulada se ha apoyado en una gran variedad de sistemas informáticos para la realización de sus funciones de negocio. Además, el actual marco normativo se ha ido adaptando para dotar de mejor aseguramiento al estado de control de los sistemas informáticos durante todo su ciclo de vida, con especial foco en la calidad e integridad del dato.
Las guías de Data Integrity de los diferentes autoridades y agencias reguladoras, junto con el nuevo enfoque CSA de la FDA sobre Computer System Assurance, y la consecuente próxima publicación de la segunda edición de la Guía GAMP 5 tras 14 años de su primera edición, hace que el entorno de la industria Life Science ponga de nuevo el foco, aún más si cabe, en la gestión del ciclo de vida de los sistemas informáticos, así como en el ciclo de vida del dato.
Ciclo de vida de los sistemas informáticos
Disponer de un Sistema de Calidad IT es un elemento clave para asegurar el correcto ciclo de vida de nuestro sistema informático. Además. en un entorno cada vez más complejo y de mayor especialización técnica, la implicación del proveedor de la aplicación y/o tecnológico cobra mayor relevancia, por lo que es crucial su adecuada evaluación.
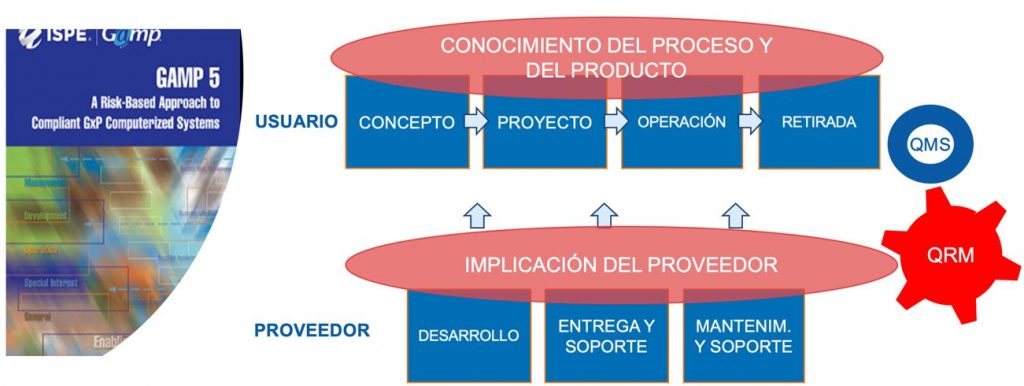
Las fases del ciclo de vida de un sistema informático según la Guía GAMP 5 son las siguientes:
- Concepto: Establecimiento de los requerimientos, descripción general y consideraciones de diseño
- Proyecto: Planificación, selección del proveedor y de la solución, especificaciones detalladas del sistema, y validación
- Operación: Gestión del sistema en su fase operativa (ej.: operación, mantenimiento, gestión de cambios y configuración, revisiones periódicas, incidencias, copia de seguridad, restauración de datos, seguridad lógica y física, plan de contingencia).
- Retirada: Retirada, migración, sustitución del sistema
Además, existen procesos o actividades de apoyo que tienen lugar en las fases del ciclo de vida que salen reforzadas inherentemente en el nuevo concepto CSA, como es la gestión de riesgos, la gestión del conocimiento, el pensamiento crítico, las buenas prácticas documentales, y/o la evaluación del proveedor.
Validación de sistemas informáticos
Según la FDA (21 CFR part 11), la validación de un sistema informático es la confirmación mediante examen y provisión de evidencias objetivas que las especificaciones de un sistema informatizado son conformes a los requerimientos del usuario y a su uso previsto, y que todos los requerimientos pueden ser consistentemente cumplidos.
Se trata pues de una actividad destinada a asegurar el uso previsto del sistema informático con el fin de cumplir con el marco regulador aplicable, así como conseguir las autorizaciones y certificaciones necesarias. Esta actividad además nos permite conocer mejor nuestro sistema, sus vulnerabilidades y oportunidades de mejora, no sólo en lo referente a aspectos de calidad, sino también de productividad. Aplicar una buena metodología en nuestro proyecto de validación permite una reducción del coste y tiempo necesarios para conseguir un sistema conforme, garantizando el cumplimiento de los requisitos y de las perspectivas reguladoras desde el inicio.
Ciclo de vida del dato
Con el nuevo enfoque Data Integrity, además de asegurar el correcto ciclo de vida del sistema informático, debemos asegurar el ciclo de vida del dato (principio ALCOA+).
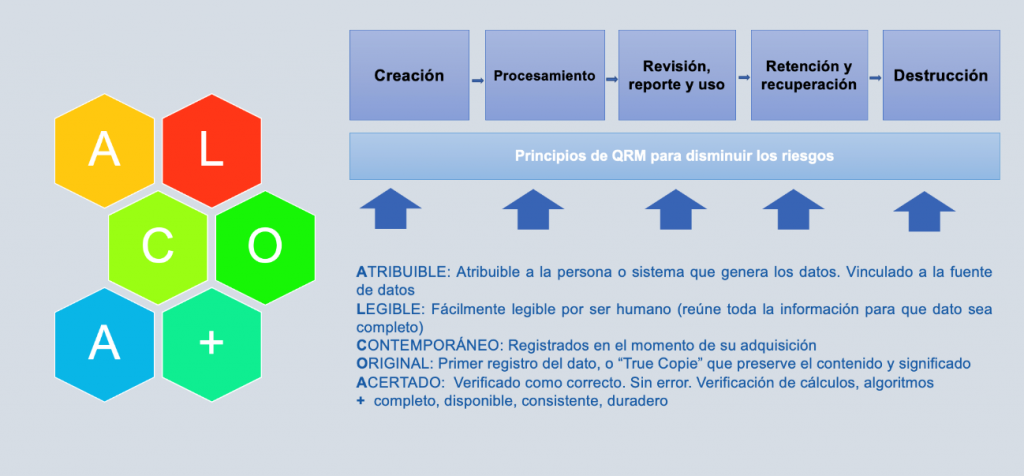
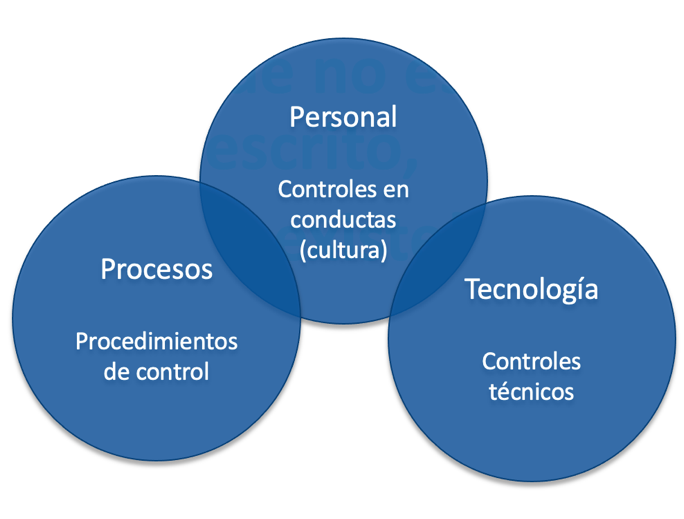
Para ello, es crucial el poseer de un sistema maduro que incorpore la Gobernanza de los datos que abarque los siguientes conceptos clave.
Normativas de referencia de sistemas informáticos
Las empresas Life Science deben disponer de un sistema de gestión de calidad que asegure el correcto ciclo de vida de los sistemas informáticos y de sus datos conforme al marco regulador del producto en cuestión:
- 21 CFR Part 11: Criterios dirigidos por FDA para asegurar que los registros y firmas electrónicas son fiables y equivalentes a los registros y firmas escritas en papel.
- Anexo 11 de las EU GMP: Requisitos de la comisión europea para los sistemas informáticos. Cuando un sistema informático reemplace una operación manual, no debe ser en detrimento de la calidad del producto, control del proceso o garantía de calidad. No debe haber un incremento del riesgo total del proceso.
- Guía GAMP5: Guía desarrollada por la ISPE que promueve un ciclo de vida del sistema informático basado en buenas prácticas. Clarifica las responsabilidades y roles entre la industria farmacéutica y los proveedores de sistemas informáticos.
- Guía GAMP IT Infrastructure Control and Compliance: Guía desarrollada por la ISPE que incluye la orientación para el control adecuado de la infraestructura informática (nuevas tecnologías de virtualización, sistemas/plataformas cloud / XaaS, seguridad, servidores, redes).
- Data Integrity: Guías específicas de la FDA, MHRA, WHO, PIC/S, EMA, GAMP para asegurar la veracidad, consistencia, trazabilidad y disponibilidad de los datos durante todo el ciclo de vida de los datos.
- Normas específicas de productos sanitarios:
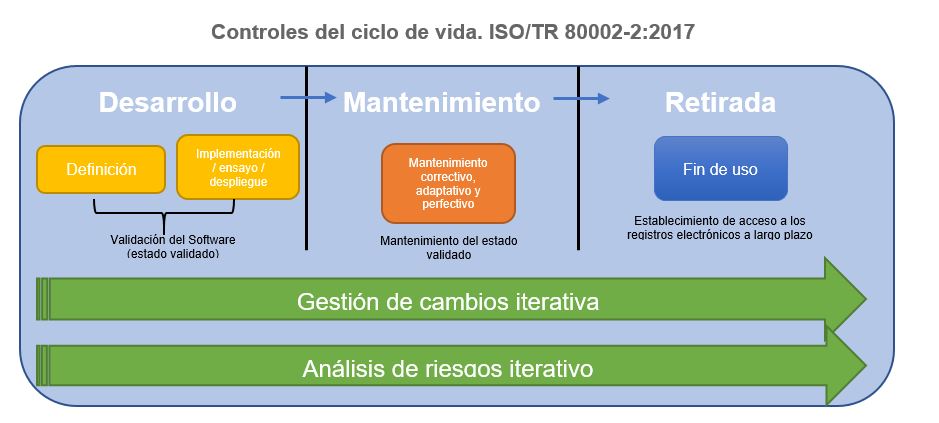
- ISO/TR 80002-2:2017 Medical device software – Part 2: Validation of software for medical device quality systems
- UNE-EN 62304:2007/A1:2016 Software de dispositivos médicos. Procesos del ciclo de vida del software.
- UNE-EN ISO 14971:2019 Dispositivos médicos/productos sanitarios. Aplicación de la gestión del riesgo a los MD.
- UNE-EN 82304-1:2017 Software sanitario. Parte 1: Requisitos generales para la seguridad de los productos (Ratificada por la Asociación Española de Normalización en octubre de 2017.)
- UNE-CEN ISO/TS 82304-2:2021 Software sanitario. Parte 2: Apps de salud y bienestar. Calidad y confiabilidad (ISO/TS 82304-2:2021) (Ratificada por la Asociación Española de Normalización en septiembre de 2021).
¿Qué ofrece Trescal?
Desde TRESCAL ofrecemos servicios de soporte relativos al ciclo de vida del sistema informático (sistema de gestión de calidad/producción), y/o del software de dispositivo médico según las normativas de aplicación, ofreciendo consultoría específica en las siguientes materias:
- Establecimiento de los requerimientos técnicos y reguladores.
- Revisión del diseño.
- Proceso de desarrollo y mantenimiento del software de dispositivo médico.
- Evaluaciones de Sistemas informáticos y Data Integrity: verificación 21 CFR Part 11, Data Integrity Risk Assessment (DIRA), data process mapping, GAP analysis, data integrity remediation plan, orphan data check).
- Desarrollo del VMP / VP.
- Establecimiento de estrategias.
- Desarrollo de los expedientes de validación.
- Pruebas de aceptación FAT / SAT / Comisionado.
- Cualificacion de Infraestructura IT (QP, RA, DQ, IQ, OQ, PQ, gestión de cambios y revisión periódica).
- Evaluación de proveedores de SW / tecnológicos.
- Acompañamiento a proveedores en pruebas de aceptación.
- Preparación de procedimientos de gestión y mantenimiento del sistema informático.
- Implantación de Sistemas de Calidad IT. Sistemas de Calidad para desarrolladores de software.
- Reevaluaciones periódicas.
- Procesos de migración de datos.
- Evaluación ante la retirada de un sistema informático.
- Plan de Transformación CSA.
- Actividades de formación dirigida.
TRESCAL es un proveedor global de servicios para la industria Life Science que ofrece servicios de implantación/consultoría de calidad, GxP, Quality Risk Management, Data Integrity, validación de sistemas y cualificación de infraestructura IT. Nuestro conocimiento específico y transversal nos permite ofrecer un servicio global de calidad como especialistas en la materia en los puntos que necesiten.
Si está evaluando la necesidad de contar con un proveedor experto para asegurar y agilizar la correcta consecución del ciclo de vida de su sistema informático y/o infraestructura IT, ahorrando imprevistos y recursos, no pierda más tiempo y contacte con nosotros, nos encantará tener noticias suyas y sumarnos a su proyecto.